Klór és vegyületei
R-H + Cl2 = R-CI + HCI
3. A laboratóriumban elkészített hatás konc. H2 SO4 a kloridok:
H2 SO4 (konc.) + NaCl = 2HCl ↑ + NaHSO 4 (enyhe melegítés közben)
H2 SO4 (konc.) + 2NaCl = 2HCl ↑ + Na 2SO 4 (nagyon erős fűtés)
HCI nagyon jól oldódik vízben: amikor. T 1 liter H 2O feloldjuk
450 liter gázt (oldódás kíséri felszabadulása jelentős hő). A telített oldatot egy tömegtörtje HCI, egyenlő 36-37%. Ez a megoldás nagyon éles, fojtó szagú.
HCI vízmolekula szinte teljesen disszociál ionokra, azaz. E. vizes HCl-oldat erős sav.
1. HCI vízben oldjuk mutat minden tulajdonságait közös savak jelenléte által okozott ionok H +
1. Minden oxoacids klórt és sóik hatásos oxidáló szerekkel.
2. Szinte minden a vegyületek bomlik melegítés hatására miatt intramolekuláris oxidációs-redukciós vagy diszproporcionálódás.
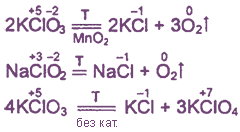
fehérítő
A perklórsav (fehérítő por) mész - keveréke hipoklorit és kalcium-klorid, egy fehérítő és fertőtlenítő. Néha tekinthető egy példa a kevert só, amelynek a szerkezetében két savak anionjai egyidejűleg:
zhavelevoy víz
A víz és a kálium-klorid oldat gapohlorita KCl + KClO + H2 O