Hidrogén-peroxid - egy
A hidrogén-peroxid (hidrogén-peroxid), H 2 O 2 - legegyszerűbb képviselőjéből peroxidok. Színtelen folyadék „fémes” íz. végtelenül oldódik vízben. alkohollal és éterrel. Tömény vizes oldatai, robbanásveszélyes. Hidrogén-peroxid egy jó oldószer. A víz formájában szabadul fel egy instabil kristályos H2 O2 • 2H2 O.
Egy molekula, hidrogén-peroxid a következő szerkezetű:
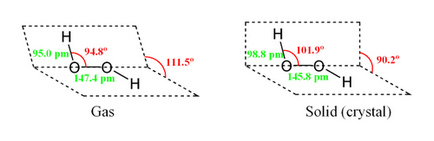
Mivel az aszimmetria a molekula H2 O2 erősen poláros (μ = 0,7 · 10 -29 m · Cl). A viszonylag nagy viszkozitása a folyékony hidrogén-peroxid által okozott kifejlesztett rendszer hidrogénkötések. Mivel az oxigén atomok osztatlan elektronpár, H2 O2 molekula is képes képezni donor-akceptor kötés.
kémiai tulajdonságok
Mindkét oxigénatom egy köztes oxidációs állapota -1, ami a kapacitást, hogy jár, mint a peroxidok, mint oxidáló szerekkel és redukálószerekkel. A legjellemzőbb ezek oxidáló tulajdonságai:
A reakciót erős oxidáló szerekkel hidrogén-peroxid működik, mint egy redukálószer, oxidálódik, hogy az oxigén:
Hidrogén-peroxid-molekula erősen poláros, amelyek folytán hidrogénkötések molekulák között. Kommunikációs O-O instabil, így H2 O2 - instabil vegyület könnyen bomlik. Emellett azt is hozzájárulhat a jelenléte átmeneti fémionok. Híg hidrogén-peroxid szintén nem stabil, és spontán diszproporcionálási O2 és H2 O A reakciót katalizálja diszproporcionálódása átmeneti fémionok, bizonyos fehérjék:
Azonban nagyon tiszta hidrogén-peroxid stabil.
Hidrogén-peroxid mutat gyenge savas tulajdonságokkal (K = 1,4 · 10 -12), és így disszociál két szakaszban:
Az akció a koncentrált H2 O2 oldat alkalmazása néhány hidroxidok sok esetben lehet megkülönböztetni fém-peroxidok, amelyek úgy tekinthetők, mint egy hidrogén-peroxid-só (Li2 O2 MgO2, stb ...):
Hidrogén-peroxid egyaránt lehet oxidáló és redukáló tulajdonságai. Például, olymódon, hogy azt az ezüst-oxid redukálószerként:
A reakcióban kálium-nitrittel együtt oxidáló vegyület:
Peroxid-csoport [-O-O-] része sok anyag. Ezek az anyagok az említett peroxidok vagy peroxi-vegyületek. Ezek közé tartoznak a fém-peroxidok (Na2 O2. BaO2 et al.). Savak peroxidot tartalmazó csoport, az úgynevezett peroxosavak, például peroksomonofosfornaya H3 PO5 és peroksidisernaya H2 S2 O8 savat.
redox tulajdonságok
A hidrogén-peroxid oxidáló rendelkezik. és redukáló tulajdonságai. Oxidálódik nitrit-nitrát. kibocsátások jód jodidok fémek, osztja telítetlen vegyületek helyett a kettős kötések. Hidrogén-peroxid visszaállítja arany- és ezüstsók. és az oxigén a reakciót vizes kálium-permanganát oldattal savas környezetben.
Amikor helyreállítása H2 O2 keletkezett H2 O vagy OH, például:
Az intézkedés alapján erős oxidáló H2 O2 mutat redukáló tulajdonsága, felszabadító szabad oxigén:
KMnO4 reakciót H2-O2 használják kémiai elemzés meghatározására H2 O2:
Oxidációja szerves vegyületek hidrogén-peroxiddal (például szulfidok és tiolok) előnyösen végezzük ecetsavas közegben.
biológiai tulajdonságai
hidrogén-peroxid utal reaktív formáinak oxigén és megemelt képződése a sejtben okoz oxidatív stressz. Egyes enzimek. például a glükóz-oxidáz. során képződött redox reakcióban hidrogén-peroxid, amely védő szerepe, mint egy baktericid hatóanyagot. Emlős sejtekben, nincs enzimek. ami csökkentené oxigén hidrogén-peroxid. Azonban számos enzimrendszerek (xantin-oxidáz. NAD (P) H-oxidáz, ciklooxigenáz, stb) szuperoxid. melyek spontán vagy az intézkedés a szuperoxid-diszmutáz alakítjuk hidrogén-peroxid.
A hidrogén-peroxidot állítunk elő az iparban képződésével járó reakciókat szerves vegyületek, különösen katalitikus oxidációja izopropil-alkohol:
Értékes melléktermék ennek a reakciónak az aceton.
Az ipari méretű, hidrogén-peroxid elektrolízissel előállított kénsav során képződött a perkénsav, majd elbontjuk az utóbbi-peroxid és kénsav.
Laboratóriumi körülmények között egy reakcióban az hidrogén-peroxid:
Koncentrálása és tisztítása a hidrogén-peroxid végezzük gondos lepárlás.
kérelem

3% -os hidrogén-peroxid-oldatot
Miatt erős oxidáló tulajdonságai a hidrogén-peroxid széles körben felhasználásra kerültek az otthoni és az iparban, ahol azt használják, például a fehérítőt a textil gyártás és a papírgyártásban. Ez valamilyen hajtóanyagként használható - mint oxidálószer vagy egyetlen komponens (elbomlik a katalizátor). Ezt alkalmazzák az analitikai kémiában. habosítószerként a termelés porózus anyagok, a termelés fertőtlenítőszerek és fehérítőszerek. Az iparban, a hidrogén-peroxid is megállapítja, a használatát, mint katalizátor, a hidrogénező ágens, például egy epoxidáló szer az epoxidációs olefinek.
Míg Híg alkalmazott hidrogén-peroxid kis felületi sérülések, vizsgálatok kimutatták, hogy ez a módszer biztosítja a szükséges tisztító és fertőtlenítő hatást, és meghosszabbítja a gyógyulási folyamatot. [1] [2] A jó tisztítási tulajdonságok, hidrogén-peroxid valójában nem gyorsítja a sebgyógyulást. Viszonylag nagy koncentrációban biztosít antiszeptikus hatása is kiterjeszthetik gyógyulási idő miatt megsérülhetnek a szomszédos sejtek a sebet. [3] Továbbá, a hidrogén-peroxid is akadályozhatják gyógyulást és elősegíti hegesedés miatt törés indítási bőrsejteket. [4] Azonban, ahogy az eszköz tisztítására komplex profil mély sebek, szeptikus csíkok, gennyedéssel. és egyéb gennyes sebek, amely meggátolta a rehabilitációs, Perique hidrogén marad a választandó gyógyszer. Mivel nem csak egy antiszeptikus hatású, de nagy mennyiségben termeli a hab, által az enzimmel reagálva peroxidáz. Ami viszont lehetővé teszi, hogy tompítsa, és külön a szövetet a nekrotikus területek, vérrögök, genny, amelyet könnyen ki lehet mosni a későbbi bevezetése az üregbe egy seb fertőtlenítő oldattal. Előkezelés nélkül, hidrogén-peroxid, fertőtlenítő oldattal nem lehet törölni adatokat patológiás képződmények, ami jelentős növekedést a sebgyógyulásban idő és ronthatja a beteg állapota.
Hidrogén-peroxid is használják hajszőkítő [5] és a fogfehérítés [6]. de mindkét esetben a hatás alapján az oxidációs és ezáltal megsemmisítése szövet, és ezért az ilyen használatra (különösen a fogak) nem ajánlott szakértők.
Az élelmiszeriparban a hidrogén-peroxid-oldatok fertőtlenítésére használt feldolgozó berendezések felületek közvetlen kapcsolatba kerülnek a termékekkel. Ezen túlmenően, a vállalkozások számára a tejtermékek gyártása, gyümölcslevek, oldatok hidrogén-peroxid használható fertőtlenítésre a csomag ( „Tetra Pak” technológia). A műszaki alkalmazások a hidrogén-peroxidot a elektronikai berendezések előállítása.
Az otthon is használt foltok eltávolításához MnO2. elő-permanganát „mangán” kálium-objektumok (miatt oxidáló tulajdonságok).
A hidrogén-peroxid az akváriumban
Ez a rész hiányzik hivatkozások információforrások.
3% -os hidrogén-peroxid-oldatot alkalmazunk revitalizációjának akváriumi halak fulladás, és tisztítására tartályok és a vezérlő a nem kívánt növények és állatok az akváriumban (Hydra, halhatatlan féreg. Paraziták, algák, baktériumok, stb).
kiadás
Elérhető a vizes oldatok formájában, a standard koncentrációja 1-6%, 30, 38, 50, 60, 85, 90 és 98%. 30% -os vizes hidrogén-peroxid-oldatot stabilizált hozzáadásával nátrium-foszfát nevezzük perhidrollal.
a veszélyes
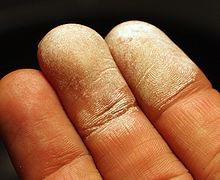
A bőr expozíció után a meg 30% -os hidrogén-peroxidot.
Annak ellenére, hogy a hidrogén-peroxid nem toxikus. Tömény oldatok érintkezve bőrön, a nyálkahártyákon és a légutakban égési sérüléseket okozhat. A nagy koncentrációban nem eléggé tiszta hidrogén-peroxid lehet robbanásveszélyes. Ártalmas lenyelés tömény oldatok. Okok kifejezve pusztító változások hasonló a hatása a lúg. A halálos adag 30% -os hidrogén-peroxid-oldatot (perhidrollal) - 50-100 ml. [7]
irodalom
Nézze meg, mit „hidrogén-peroxid” más szótárak:
Hidrogén-peroxid - Hidrogén-peroxid Szisztematikus Köznapi név Kémiai képlet Hidrogén-peroxid ... Wikipedia
A hidrogén-peroxid - Hidrogén-peroxid Általános Szisztematikus név Hidrogén-peroxid Kémiai képlet ... Wikipedia
Hidrogén-peroxid - (hidrogén-peroxid), H2O2, folyékony, B.P. 150,2shC. 30% hidrogén-perc perhidrollal oldatot. Tömény vizes hidrogén-peroxid-oldatok robbanásveszélyes. Hidrogén-peroxidot használunk oxidálószerként a hajtóanyagnak a elkészítéséhez különböző ... ... Modern Encyclopedia
Hidrogén-peroxid - (hidrogén-peroxid), H2O2, folyékony, forráspontja 150,2 ° C-on 30% hidrogén-perc perhidrollal oldatot. Tömény vizes hidrogén-peroxid-oldatok robbanásveszélyes. Hidrogén-peroxidot használunk oxidálószerként a hajtóanyagnak a elkészítéséhez különböző ... ... Illustrated Encyclopedic szótár
Peroxid - (korábban peroxid) tartalmú anyag peroxo O O (például H2O2 hidrogén-peroxid, nátrium-peroxid, Na2O2). Peroxid oxigént bocsát ki könnyen. akkor ajánlott, hogy használja a kifejezés szervetlen peroxiddal vegyületek, ... ... Wikipedia
A cézium-peroxid - Általános Szisztematikus név peroxid cézium hagyományos nevek cézium-peroxid Kémiai képlet Tapasztalati képlet Cs2O2 Cs2O2 ... Wikipedia
Peroxid króm (VI) - peroxid, króm (VI) CrO (O2) 2 vagy CrO5, kék anyag nem tiszta formában izoláljuk. Ismeretes oldatban vagy szolvátok formájában a szerves oldószerek. Szisztematikus név ... Wikipedia
Peroxid higany - Általános Szisztematikus név peroxid higany hagyományos nevek peroxiddal higany HgO2 Kémiai képlet fizikai tulajdonságai Móltömeg ... Wikipedia
cink-peroxid - Általános Szisztematikus név cink-peroxid hagyományos név Cink-peroxid Kémiai képlet ZnO2 fizikai tulajdonságai állapota (... Wikipedia