Az oxidáció mértéke - ami hogyan kell meghatározni az értékét az oxidáció mértékét elemek
Egy ilyen tantárgy, mint a kémia okoz számos nehézség a legtöbb mai diákok, nagyon kevés ember képes meghatározni az oxidáció mértékét a vegyületek. A legnagyobb nehézséget az iskolás gyerekek, akik tanulmányozzák a szervetlen kémia, azaz az általános iskolások (8-9 fokozat). Object félreértés vezet, hogy nem szeretik az iskolások a témát.

Milyen témák kémia során a diákok a legnehezebb?
Az új program keretében a fegyelem „Chemistry” általános iskolában is több fő téma: elemek periódusos D. I. Mendeleeva, szervetlen anyagokat osztályok, ioncsere. Legnehezebb adott gréderek meghatározza az oxidáció mértékét az oxidok.
elhelyezési szabályok
Először az összes hallgató tisztában kell lenniük azzal, hogy a két-elem oxidok azok komplex vegyületek, amelyekben a kompozíció tartalmazza oxigént. Ennek előfeltétele bináris tartozó vegyület osztályába oxidok jelentése oxigénatom második helyen, egy adott vegyület.
Számítja ki az adott index az adott osztályban képletek kapunk, ha a hallgató egy adott algoritmus.
Algoritmus savas oxidok
Először, megjegyezzük, hogy az oxidáció mértékét egy számszerű kifejezése a vegyérték az elemek. A savas oxidok képződnek fémekkel vagy nemfémes elemek vegyértékű négy évről hét, egy második van szükség az ilyen oxidok jelentése oxigénatom.
Az oxigén vegyérték-oxidok mindig megfelel a két, lehet meghatározni szerinti elemek a periódusos D. I. Mendeleeva. Ez egy tipikus, nem-fém, mint az oxigén, míg a 6. csoport a periódusos fő alcsoport kap két elektront teljesen elkészült külső energia szintet. Nem-fémek az oxigén-vegyületek gyakran a legnagyobb vegyértéket, amely megfelel a szám a csoport maga. Fontos emlékeztetni, hogy az oxidáció mértékét a kémiai elemek indikátora feltételezve pozitív (negatív) számok.
Nemfémes Állandó elején egy képletben van egy pozitív oxidációs állapotú. Nemfémes oxidok az oxigén-stabil, a fénytörési -2. Annak érdekében, hogy ellenőrizze a pontosságát az összehangolás értékek savas oxidok kell szorozni a számokat hozott az indexek az adott elem. A számítások tekinthető érvényesnek, ha az összessége az előnye és hátránya a készlet 0 fok kapunk.

Előállítása kételemű képletek
Az oxidáció mértéke az atomi elemeket van esélye, hogy hozzon létre és rögzítéséhez vegyület két elem. Amikor létrehoz egy képlet kiindulási mindkét szimbólum közelében előírt, gondosan második oxigént kell adni. Tetején minden a rögzített jelek előírt értékét az oxidációs fokú, majd találni a számok az a szám, amely lehet nélkül osztható mindkét számot. A mutató kell osztani által egyedileg számértéke az oxidáció mértékét szerezni indexek az első és a második alkotórésze a két-elem anyaga. Magasabb oxidációs állapotban van számszerűen egyenlő a értékkel magasabb vegyértékű tipikus nemfémes azonos a csoport száma, ahol a PS egy nemfémes.
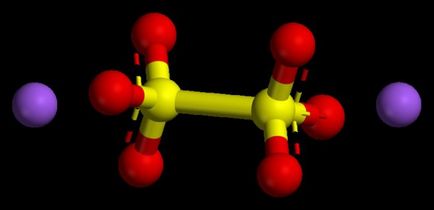
Az algoritmus teljesítményének számszerű értékek az alap-oxidok
Az ilyen vegyületeket tekintjük tipikus fém-oxidok. Ezek az összes vegyület volt, amelynek mértéke a oxidációs állapota nem több, mint egy vagy kettő. Ahhoz, hogy megértsük, mi lesz az oxidáció mértékét a fém, lehetséges, hogy kihasználják a periódusos rendszerben. A fémek a fő alcsoportok az első csoport, ez a lehetőség mindig állandó, ez hasonló a csoport száma, ez az egyik.
Fémek fő alcsoportja a második csoport is jellemzi egy stabil oxidációs állapotban +2 numerikusan. Az oxidáció mértéke a mennyisége oxidok tekintettel azok indexek (számok) kell adni nulla, mivel a kémiai tekinthető egy semleges molekula, nélkülözi a töltött részecske.
A beállító oxidációt az oxigén-tartalmú savak
Savak összetett anyag, amely egy vagy több hidrogénatom, amelyek kapcsolatban vannak bizonyos savmaradék. Tekintettel arra, hogy az oxidáció mértékét egy numerikus célok kiszámítására igényel matematikai készségek. Egy ilyen indikátor hidrogén (proton) mindig savakban stabil, a +1. Továbbá lehetőség van arra, hogy jelezze az oxidáció mértékét a negatív oxigén-ion, az is stabil, -2.
Csak miután ezeket a lépéseket, akkor lehet számítani, az oxidáció mértékét a központi eleme a képlet. Mivel egy adott mintát úgy meghatározó elemek az oxidáció mértékét a kénsav, H2SO4. Tekintettel arra, hogy a molekulában a komplex anyag tartalmaz két hidrogénatom proton, 4 oxigénatomot, megkapjuk kifejeződése formájában + 2 + X-8 = 0. Annak érdekében, hogy Összefoglalva képződött nulla, y jelentése a mértéke kén oxidációs +6
A beállító oxidációját a sók
A sók komplex vegyületek álló fémionok, valamint egy vagy több anion. Meghatározására szolgáló eljárások az oxidáció mértékét az egyes komponenseket a komplex só ugyanaz, mint az oxigén-tartalmú savak. Tekintettel arra, hogy az oxidáció mértékét elemek - digitális kijelző, fontos, hogy jelezze az oxidáció mértékét a fém.
Ha a fém formázó a só a fő alcsoport, annak oxidációs állapotát stabil, csoportnak megfelelő szám pozitív. Ha a só tartalmaz egy fém, például alcsoportok PS kiállító valenciájú, a fém vegyértékétől tudja határozni a-maradék. Amikor az oxidáció mértékét a fém kell telepíteni, tegye az oxidáció mértékét az oxigén (-2), majd kiszámítjuk a oxidációs foka a központi test segítségével a kémiai egyenlet.
Példaként tekintsük a meghatározása oxidációs állapotok a elemek a nátrium-nitrát (normál só). NaNO3. Sol fő alcsoportja a csoport 1 fém képződik, ezért az oxidáció mértékét nátrium +1. A oxigén nitrát oxidációs állapotban -2. Ahhoz, hogy meghatározzuk a számértéke oxidációs felel + 1 + X-6 = 0. -Egyenlet, azt kapjuk, hogy X kell 5, ez az oxidáció mértékét a nitrogén.

Kulcsfontosságú fogalmak a IAD
Vannak speciális feltételeket, amelyek szükségesek, hogy megtanulják a diákok az oxidációs és redukciós folyamat.
A mértéke az oxidációs, hogy képes irányítani csatolni magát (így különböző) elektronokat néhány ionok vagy atomok.
A oxidálószer tartják semleges atomok vagy ionok a kémiai reakció során magát csatlakozik elektronok.
A redukálószer töltetlen atomok vagy ionok, hogy a folyamat a kémiai kölcsönhatás elvesztik saját elektronokat.
Az oxidációs eljárás képviseli, mint elektron impakt.
Recovery társul elfogadása további elektronok töltés nélküli atomot vagy -iont.
Redox eljárás azzal jellemezhető, a reakció, a amelynek során szükségszerűen változik az oxidáció mértékét egy atom. Ez a meghatározás lehetővé teszi számunkra, hogy megértsük, hogyan lehet megállapítani, hogy a reakció az ISI.

OVR elemzési szabályokat
Ezt az algoritmust, az együtthatók lehet elhelyezni bármely kémiai reakció.
Először meg kell hozni az egyes kémiai oxidációs állapotban van. Figyeljük meg, hogy az egyszerű anyag oxidációs állapota nulla, mivel nincs kimenet (kapcsolat) negatív részecskéket. Feltételek elhelyezése oxidációs bináris és három-elem vegyületeket általunk vizsgált fenti.
Ezután meg kell, hogy azonosítsuk azokat atomok vagy ionok, amelyek során történt átalakítás, oxidációs megváltozott.
Felvett a bal oldalon az egyenlet van izolált atomok vagy ionok, amelyek megváltoztatták oxidáció mértéke. Szükséges, hogy a mérlegben. Az elemek köteles megjelölni az értéküket.
További írásbeli azok az atomok vagy ionok, amelyek a reakció során keletkező, a + jel azt jelzi, az elektronok száma elfogadott atom, - a száma öntött negatív részecskék. Ha a folyamat a kölcsönhatás van kisebb oxidációs állapotban. Ez azt jelenti, hogy az elektronok vettünk atom (ion). Amikor az oxidáció mértékét atom (ion) adományozni elektronok a reakció során.
A legkisebb teljes száma hozott osztani az első, majd a leadott során elektronok kapott együtthatók. Pont számok a szükséges sztereokémiái tényezők.
Határozzuk oxidálószer, redukálószer, folyamatok fordulnak elő a reakció során.
A végső lépés az lesz a nyomvonal a sztereokémiai tényező ebben a reakcióban.
például OVR
Nézzük gyakorlati alkalmazása az algoritmus egy adott kémiai reakció.
Kiszámítjuk minden egyszerű és összetett anyagok.
Mivel Fe és Cu egyszerű anyagok, azok oxidációs állapotban értéke 0. Az CuSO 4, Cu + 2, majd 2 oxigén-, kén- és a +6. A FeSO4: Fe +2, tehát, egy O 2, számított az S +6.
Most keresi az elemek, amelyek megváltoztatták volna a számokat, mi a helyzet, akkor lesz a Fe és Cu.
Mivel az érték a reakció után a vas-atom volt 2, 2 elektron kapott a reakcióban. Réz indexeik változott 2-0, úgy, hogy a réz-tett 2 elektront. Most határozzuk meg az elektronok száma kapott, és öntöttvas atom és réz kation. Átalakítás során hozott kation két elektron kupri ugyanazon elektron adott vas atomot.
Ebben a folyamatban nem releváns, hogy meghatározzák a minimális közös többszöröse, mint amennyit és során adott konverzió elérte az elektronok száma. Sztereokémiái tényezők is felelnek az egyhez. A reakcióban a redukálószer mutat tulajdonságai a vas, míg oxidálódik. Kation kétértékű réz redukálódik tiszta réz a reakció azt a legmagasabb oxidáció mértéke.

A jelentkezés folyamata
Formula oxidáció mértéke ismernie kell minden iskolás 8-9 osztály, mivel ez a kérdés szerepel a munkát OGE. Bármilyen folyamatok fordulnak elő oxidáló, a tünetek csökkentésére fontos szerepet játszik az életünkben. Ezek nélkülözhetetlenek az anyagcsere folyamatokat az emberi szervezetben.