molekulatömeg
A tömegek az atomok és molekulák különböznek jelentősen. Milyen értékek jellemzik azokat kényelmesen? Hogyan állapítható meg, az atomok számát minden makroszkopikus test?
Súlya a vízmolekulák. Súlyok az egyes molekulák és atomok nagyon kicsi. Például, 1 g víz tartalmazott 3,7 • október 22-molekulák. Következésképpen, a tömege egy molekula víz (H2 0) egyenlő:
A tömege ugyanabban a sorrendben vannak más anyagok molekuláit, kivéve a hatalmas molekulák szerves anyagok; például a fehérjéknek a súlya több száz ezerszer nagyobb, mint az a tömeg az egyes atomok. De még mindig súlyuk makroszkopikus méretekben (gramm és kilogramm) rendkívül kicsi.
Relatív molekulatömeg. Mivel a molekulatömeg nagyon kicsi, amelyet nem használnak a számítás abszolút tömegértékek de viszonyítva. A nemzetközi megállapodás összesített tömege az atomok és a molekulák képest 1/12 tömegének egy szénatom (úgynevezett szén tömege atomi skála). Relatív molekulatömeg (vagy atomi) tömegaránya a tömeg hívja veschestvaMr molekulát (vagy atom) m0 anyagot 1/12 tömegének szénatom m0C:
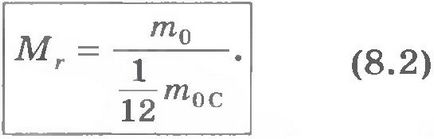
A relatív atomi tömegek minden a kémiai elemek pontosan mérhető.
Hozzáadása a relatív atomsúlya a alkotó elemek az anyag a molekula, ki lehet számítani a relatív molekulatömege az anyag. Például, a relatív molekulatömege a szén-dioxid CO2 közelítőleg egyenlő a 44, mivel a relatív atomtömeg szén pontosan megegyezik a 12, és az oxigén körülbelül 16: 12 + 2 = 44 16 •.
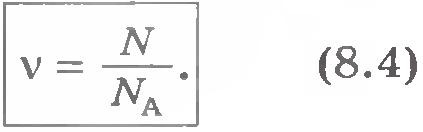
Az anyagmennyiség és az Avogadro-állandót az anyag mennyiségét legtermészetesebb számát mérjük az atomok vagy molekulák a szervezetben. De a molekulák számának bármilyen makroszkopikus test olyan nagy, hogy a számítások nem az abszolút molekulák száma, és a relatív számát.
A Nemzetközi Mértékegység Rendszer mennyiségű anyagot kifejezett mol. Egy mól - egy bizonyos mennyiségű anyag, amely tartalmazza az azonos számú molekulák vagy atomok, mint szénatomot tartalmaz a tömege 0,012 kg.
Ez azt jelenti, hogy 1 mól bármely anyag tartalmazza az azonos számú atomok vagy molekulák. Ez az atomok száma kijelölt NA az Avogadro-szám és neve után az olasz tudós (XIX.).
Ahhoz, hogy az Avogadro-állandó kell találni a tömege egy szénatomot tartalmaz. Egy közelítő becslés a tömeg lehet, mint történt az előzőekben az tömegének egy vízmolekula (legpontosabb módszerek alapján az eltérés ionsugarakat elektromágneses mező).
A súlyának mérése A szénatomos így :.
NA Avogadro-szám lehet meghatározni elosztjuk a súlya a szén vett mennyiségben egy mól, a súlya a szénatom:
Rendeltetése mol -1 azt jelzi, hogy NA - az atomok száma 1 mól bármely anyag. Ha például az anyag mennyiségét. a molekulák száma a szervezetben. Ez azt mutatja, hogy az összeg egy anyag az arány a N számú molekulák a szervezetben, hogy az Avogadro-állandót NA. .. Ie a molekulák számának 1 mol az anyag:
Hatalmas számérték Avogadro azt jelzi, hogy a kis mikroszkopikus méretű, mint a makroszkopikus. Testet, amelynek az anyag mennyiségét 1 mol, az ismerős számunkra makroszkopikus méretei és tömege a sorrendben több tíz gramm.
A moláris tömeget. Együtt relatív molekulatömegű úr a fizikai és kémiai széles körben használt fogalom moláris tömeget. Móltömeg M nevű anyag súlya anyagokat vett mennyiségben 1 mól.
E meghatározás szerint, a moláris tömege egy anyag a termék molekula tömeg a Avogadro-állandó:
Tömeg m bármely anyag mennyisége a termék tömegének molekula száma molekulák a szervezetben:
Cseréje NA és N általános képletben (8.4) által kifejezések általános képletű (8,5) és (8,6), megkapjuk
A hatóanyag mennyisége megegyezik a tömege anyag moláris tömege. Ez a meghatározás az anyag mennyiségét adják a tankönyv kémia.
A molekulák száma bármely anyag mennyisége m a tömeg és moláris tömege szerinti egyenletek (8,4) és (8,7) a következő:
Képletek (8.2), (8.4) és (8.5), így a meghatározása egy új fizikai mennyiségek, mint például a relatív molekulatömege, a számát az anyagok és a móltömeg. Ha nem kap őket, legyen könnyen megjegyezhető. A többi általános képletű, például (8,7) és (8,8) lehet levezetni.
.
1. Mi a relatív molekulatömeg a víz?
2. Hány molekula van a két mol víz?
3. Tud bizonyítani, hogy a moláris tömege van társítva relatív molekulatömeg-aránya M≈10 -3 úr mol • kg -1
(A bizonyítva használatához szükséges képletű (8,5), (8,2), valamint a tömege szénatomot és az Avogadro-állandó.)
G.Ya.Myakishev, B.B.Buhovtsev, N.N.Sotsky Fizika 10 osztály
Ha javításokat és javaslatokat a leckét, kérjük lépjen kapcsolatba velünk.
Ha azt szeretnénk, hogy a többi beállítást és javaslatokat órák, nézd meg itt - Oktatási fórum.